Notícia
Nanopartículas podem melhorar desempenho de células imunológicas
Drogas transportadas em conjunto com células ajudam células T a destruir tumores
Warning: foreach() argument must be of type array|object, null given in /home/u393669806/domains/t4h.com.br/public_html/wp-content/plugins/k-elements/functions/after-setup-theme.php on line 55
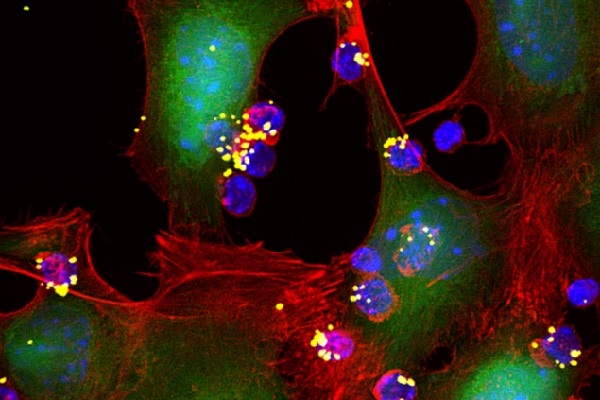
Sudha Kumari and Yiran Zheng
Fonte
MIT | Instituto de Tecnologia de Massachusetts
Data
quarta-feira, 11 julho 2018 12:00
Áreas
Biologia Celular e Molecular. Engenharia Biológica.
A programação do sistema imunológico do corpo para atacar as células cancerígenas teve resultados promissores no tratamento de cânceres no sangue, como linfoma e leucemia. Essa tática se mostrou mais desafiadora para tumores sólidos, como câncer de mama ou pulmão, mas os pesquisadores do Instituto de Tecnologia de Massachusetts (MIT), nos Estados Unidos, criaram uma nova maneira de estimular a resposta imune contra tumores sólidos.
Desenvolvendo “mochilas” de nanopartículas que seguram drogas imunoestimulantes, e ligando-as diretamente às células T, os engenheiros do MIT mostraram em um estudo com camundongos que eles poderiam aumentar a atividade dessas células T sem efeitos colaterais prejudiciais. Em mais da metade dos animais tratados, os tumores desapareceram completamente.
“Descobrimos que você poderia melhorar muito a eficácia da terapia de células T com drogas que ajudam as células T do doador a sobreviver e a funcionar de forma mais eficaz. Ainda mais importante, conseguimos isso sem a toxicidade que você vê com a injeção sistêmica das drogas ”, diz o Dr. Darrell Irvine, professor de engenharia biológica e de ciência e engenharia de materiais, diretor associado do Instituto Koch de Pesquisa Integrativa sobre o Câncer do MIT. e o autor principal do estudo.
O Dr. Irvine é um dos co-fundadores da empresa Torque Biotherapeutics, que planeja iniciar ensaios clínicos dessa abordagem. Os principais autores do artigo, que aparece na edição de 9 de julho da revista científica Nature Biotechnology, são o ex-pós-doutorado do MIT Li Tang, que agora está no Instituto Federal de Tecnologia da Suíça (EPFL), e o ex-aluno do MIT Yiran Zheng.
Para este estudo, os pesquisadores criaram um novo tipo de nanopartícula que pode transportar uma quantidade de droga 100 vezes maior e não a libera até que as células T encontrem o tumor. Estas partículas consistem de um gel feito de moléculas da citocina IL-15 agregadas por um agente de reticulação que é projetado para se degradar apenas quando a célula T que transporta as partículas atinge o tumor e se torna ativada. Essa ativação é sinalizada por uma alteração química na superfície das células T.
“Isso nos permitiu ligar a ativação das células T à taxa de liberação de drogas”, explica o Dr. Irvine. “Os nanogéis são preferencialmente dissolvidos quando as células T estão em locais onde eles veem o antígeno do tumor: no tumor e nos linfonodos que drenam o tumor. A droga é liberada com mais eficiência nos locais onde você quer e não em algum tecido saudável, onde pode causar problemas”, conclui o pesquisador.
Acesse a notícia completa na página do MIT (em inglês).
Acesse o resumo do artigo científico (em inglês).
Fonte: Anne Trafton, MIT News Office. Imagem:
Em suas publicações, o Portal Tech4Health da Rede T4H tem o único objetivo de divulgação científica, tecnológica ou de informações comerciais para disseminar conhecimento. Nenhuma publicação do Portal Tech4Health tem o objetivo de aconselhamento, diagnóstico, tratamento médico ou de substituição de qualquer profissional da área da saúde. Consulte sempre um profissional de saúde qualificado para a devida orientação, medicação ou tratamento, que seja compatível com suas necessidades específicas.
Os comentários constituem um espaço importante para a livre manifestação dos usuários, desde que cadastrados no Portal Tech4Health e que respeitem os Termos e Condições de Uso. Portanto, cada comentário é de responsabilidade exclusiva do usuário que o assina, não representando a opinião do Portal Tech4Health, que pode retirar, sem prévio aviso, comentários postados que não estejam de acordo com estas regras.





Apenas usuários cadastrados no Portal tech4health t4h podem comentar, Cadastre-se! Por favor, faça Login para comentar